作者:写意君编译
来源:同写意
来源原文:J&J targets Chinese biotech deals as western pharma groups look east
强生(Johnson & Johnson)的一名高管表示,在私人投资和政府支持的推动下,该公司正利用中国的生物技术热潮,积极与两家中国公司谈判合作协议。
过去两年,包括礼来(Eli Lilly)、艾伯维(AbbVie)和安进(Amgen)在内的其它几家美国大型制药集团也达成了类似的协议。目前,西方制药商越来越多地寻求从中国合作伙伴处获得高潜力药物疗法的许可,再销往其他市场。强生全球肿瘤部门主管Peter Lebowitz向《金融时报》透露,“2015年之前的早些时候”,中国生物技术公司专注于研制“比现有药物稍好一些的产品”。他补充称:“不过,现在中国有了真正的创新。”他表示:“我们一直在中国寻找机会,现在正好有时机能让我们在潜在交易上进行实质性推进。”管理咨询公司麦肯锡(McKinsey)的数据显示,在2020年7月至2021年7月期间,西方制药商与中国生物技术公司达成了12项重大许可协议,交易价中值为9亿美元。麦肯锡表示,中国在香港、上海和纳斯达克交易所上市的生物制药集团的市值,已从2016年的30亿美元飙升至今天的2400亿美元——尽管全球生物技术股票在2021年出现大幅回调。
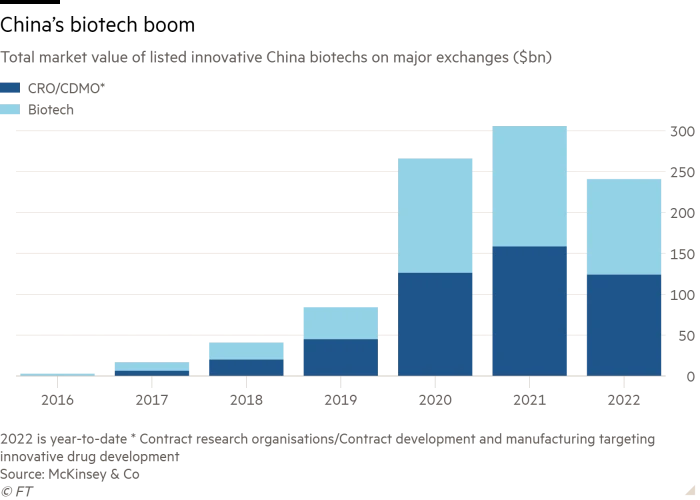
负责咨询公司西蒙顾和(Simon-Kucher & Partners)中国生命科学部门的Bruce Liu表示,中国生产了世界上大约三分之一的活性药物成分,其在药品供应链中的核心作用为建立一个创新药物中心的新角色提供了帮助。Bruce Liu表示,北京为海外的中国科学家提供了政策激励,以鼓励他们回国支持国内企业的发展。他补充称,与此同时,2018年香港交易所上市规则发生了改变:允许未有收入的制药公司公开募股,这引起了生物技术投资的“爆炸式增长”。尽管地缘政治局势紧张、COVID-19造成了物流障碍,加上美国监管机构对一些仅依据中国临床试验的药品审批申请的质量表示担忧,但西方制药商仍将重心转向了中国。传奇生物首席执行官黄颖表示,FDA希望确保临床试验数据适合美国患者。他表示,强生和传奇生物就临床试验与FDA进行了广泛磋商,这些试验最初在中国进行,后来扩展到了美国和日本。
黄颖表示:“我们很自豪能成为开拓者,为中国带来一些突破性科学发现并在美国进行研发。”
他认为,对中国生物技术行业投资的激增,正在带来科学的突破,增加了向美国这个全球最大的制药市场扩张的机会。
强生和传奇生物研发的Carvykti是一种CAR-T疗法,其工作原理是提取病人的血细胞,在实验室中对其进行重组以识别和消灭癌症,之后再将其重新输入人体。
根据Beacon Targeted Therapies的数据库显示,中国在CAR-T领域进行的临床试验比其他任何国家都多,共有492项注册研究,而美国和欧洲分别为362项和274项。
总部位于纽约的医疗基金RTW在中国有部分投资,其首席投资官Rod Wong表示,传奇生物的白细胞癌症疗法是一种“具有全球竞争力的疗法”,也是专注于癌症治疗的“第一波(中国)创新”的一部分。Rod Wong预计,中国制药公司将生产其他类型的创新药物,以解决心血管疾病等严重影响国民健康的问题。宾夕法尼亚大学(University of Pennsylvania)癌症基因治疗教授Bruce Levine表示,中国发现的治疗方法进入美国市场的速度,将取决于临床试验的实施以及严格的COVID-19限制解除的时间。他说:“在美国,我们有成熟的监管机构和质量标准。中国有一些非常好的医院……也有很多没那么好的医院,他们并不了解病人的情况。”






