孤儿药是治疗罕见疾病的药物。FDA的定义孤儿药为:“用于治疗、预防或诊断在美国影响不到20万人的罕见疾病的药物”(其中相当于每 1万人大约6例)。在欧洲,罕见病的定义为影响1万人中的不到5人。
罕见疾病相关数据:
•在全球范围内,大约存在6000-7000 种已知罕见疾病,影响了大约 3 亿人。•在已知的6千多种罕见疾病中,癌症占据了11.1%,传染性疾病约占2.6%。•72%的罕见疾病属于遗传性疾病,其余由感染、过敏、环境或罕见癌症造成。•70%的遗传性罕见疾病从儿童时期已导致,30%罹患儿童在5岁之前便已离世。•上世纪70年代市场上针对罕见病的药物种类少于10。
罕见病症孤儿药治疗案例
在1980年代,罹患囊肿性纤维化的人很少能活过10岁。经由《孤儿药法案 (ODA)》协助而开发出的药品如阿法链道酶(商品名Pulmozyme®) 和妥布霉素(Tobramycin,图1),使得该疾病的治疗发生了革命性的改变,大幅改善患者的生活品质和延长预期寿命。现在这类患者通常活到三十多岁,有些则活到五十多岁。
有两位研究人员因为在家族性高胆固醇血症(导致胆固醇水准大幅快速升高)方面的研究获得1985年诺贝尔生理学或医学奖。他们的工作导致他汀类药物(例如洛伐他丁lovastatin,图2)的开发,这类药品现通常用于治疗有高胆固醇状况的人。
青霉胺(Penicillamine,图3)用于治疗罕见的遗传性疾病威尔森氏症,这种症状可导致体内铜的积累而产生致命性的结果。后来这种药品被发现可有效治疗关节炎。
FDA在2017年授予RT001(二氘化亚油酸乙酯,用于治疗PLA2G6相关神经变性 (第一型脑内铁沉积性神经系统退化症,图4)孤儿药的初步核准。
Patisiran (商品名Onpattro®) 涉及RNA疗法的新型机制,可阻止异常形式的转甲状腺素蛋白产生,而获得FDA孤儿药初步核准和突破性疗法初步核准。Patisiran于2018年正式获得FDA核准上市。
孤儿药历史、市场现状与展望
美国《孤儿药法案 (ODA)》 于 1983 年通过,它激发了全球范围内类似政策的诞生。孤儿药现在约占所有新批准的药物和生物制剂的三分之一(图5)。图5. 2004-2019年FDA审批孤儿药与非孤儿药数量对比图美国是第一个为孤儿药立法的国家,之后,其他一些国家纷纷效仿,例如新加坡 (1991)、日本 (1993)、澳大利亚 (1998) 和欧盟 (EU) (2000)。美国主导全球孤儿药市场,约占据70% 的全球销售额。孤儿药的治疗领域涵盖了包括肿瘤学、血液学、神经学、内分泌学、心血管、呼吸、免疫治疗等众多领域。孤儿药的主要适应症是肿瘤学,因为在全球人口老龄化的环境下不断产生不同类型的罕见癌症。在世界各国监管机构提供的开发孤儿药的激励下,许多制药公司日益加大了对该类产品的投资热情。根据预测,从 2019 年到 2024 年,全球孤儿药市场将以约 12% 的复合年增长率 (CAGR) 增长,这个数字约为非孤儿药市场预测增长率的两倍。目前,全球市场用于孤儿药的价值约为 1500 亿美元,而到 2024 年,孤儿药的市场规模预计将达到 2420 亿美元,约占全球处方药销售额的 20%。
开发孤儿药之源动力
市场独占(Market Exclusivity)通常被认为是孤儿药研发最重要的激励因素。市场独占是保护品牌药免受仿制药竞争的重要措施。不同的情况有不同的市场独占期。市场独占旨在促进新药创新和仿制药竞争之间的平衡。1)NCE (New Chemical Entity): 在大多数情况下,具有新活性成分的品牌药物具有五年的独占期; 2) Orphan Drug:针对在美国影响不到 20万患者(或影响更多人但制药公司仍无希望支付开发成本)的疾病的新品牌药物,其可享受 7 年的市场独占期;这种市场独占性阻止 FDA 批准另一种具有相同活性部分的产品用于相同的疾病或病症,除非第二种产品被证明在临床上优于第一种产品。3)New Clinical Investigation: 在某些情况下,比如开发了一种新制剂或给药方法(例如片剂而不是液体),或者发现原有活性成分的新适应症(药物再利用Drug Repurposing),那么含有此前已批准的该API的药物可以获得三年的独占期。为此,制药公司必须进行新的临床研究。除了市场独占之外,临床试验的协议援助和税收抵免也是激励制药公司开发孤儿药的动力。孤儿药策略背后的推手因素包括如下内容:
•审批低门槛
•更长的市场独占
•更低的营销成本
•更快的市场占有
•溢价定价
•税收抵免
•研发补助
•FDA费用免除
•更短的研发周期
•更大的监管准入
越来越多的孤儿药资格认定与加速开发途径齐头并进。在美国,加速途径包括快速通道、优先审查、加速批准、突破性疗法以及再生医学高级疗法。EMA则有“有条件营销许可”和“优先审评”的优惠条件。
孤儿药市场
罕见病的疗法有各种形式,从传统的小分子药物到大分子生物制剂,再到细胞和基因疗法。2018 年从孤儿药中获得最高收入的三家公司分别是新基(Celgene)、罗氏(Roche)和诺华(Novartis),全球销售额均超过 100 亿美元。新基 (Celgene) 是 2019 年孤儿药市场的领先公司,预计将在 2024 年保持这一地位,全球销售额为 137 亿美元。强生、罗氏、诺华和武田占据其余前五名,它们的预计 2024 年总收入将超过 600 亿美元,占孤儿药市场总额的 26%。预计 2024 年将主导市场的 10 家公司各自的领先孤儿药如表1所示。表1. 全球孤儿药10强及其领导产品(2018-2024)小分子药物 Revlimid®(来那度胺lenalidomide,治疗多发性骨髓瘤、冒烟型骨髓瘤和骨髓增生异常综合征 (MDS) 的药物)和 Tafinlar®(达拉菲尼dabrafenib,治疗与BRAF基因突变版本相关的癌症的药物)分别是新基(Celgene)和诺华(Novartis)的主要孤儿药,而罗氏(Roche)的单克隆抗体 Hemlibra®(emicizumab-kxwh)领导其孤儿药组合。3 与肿瘤学是孤儿药的主要适应症一致,10 种收入最高的药物中有 5 种治疗恶性肿瘤。对于非肿瘤孤儿药的销售,Vertex Pharmaceuticals、Sanofi 和 Alexion 等公司扮演先行者的角色,他们的孤儿药分别用于治疗呼吸系统、代谢和血液疾病。
图6. Lenalisomide 和 darafenib 化学结构
有了这些类型的收入,大型制药公司积极寻求收购拥有孤儿药资产的生物技术公司也就不足为奇了。就在 2019 年,百时美施贵宝以 740 亿美元完成了对 Celgene 的收购,罗氏以 48 亿美元收购了 Spark Therapeutics。
•经典的超孤儿疾病:由于缺乏合适的治疗选择而导致显著的发病率或死亡率,导致酶变体缺失或功能不正常的基因异常,以及导致的价格高昂的酶替代疗法。
•围产期发育障碍:健康婴儿的发育和分娩是一个具有巨大潜力的领域。
•基因定义的亚群:在罕见病中追求基因定义的亚群。
•难治亚群:代表特定疾病患者的晚期、复发或严重亚群。
•孤儿肿瘤疾病:小癌症类型或转移性癌症的后期治疗,其中人群相对较少且未满足的需求显著。
•“治愈性”孤儿疾病:由于细胞和基因治疗相关的技术改进而有望治愈的孤儿疾病。
•支持性孤儿护理:在需要对孤儿疾病对症支持的目标患者群体中也存在机会。
•时间压力:并非所有孤儿药都将获得快速批准途径,但对于获得快速批准途径的开发者来说,面临的挑战是与时间赛跑,在最短的时间内开发出可靠的药物生产工艺。
•生产低体量的高价值产品:治疗罕见疾病和较小患者群体的孤儿药需要小批量生产。尽管孤儿疗法的商业化过程涉及的量较小,但仍必须解决扩大规模的问题。
•分析手段的开发:分析方法需要及时开发与验证。
•药物稳定性:原料药与制剂过程会影响 API 的稳定性,因此进行稳定性测试,以了解最终药物产品的质量和稳定性受何影响至关重要。
•稀缺患者:罕见病意味着患者数量非常少,并且需要更长的时间来识别和招募足够数量的患者进行临床试验。很多时候,有资格最终参与研究的患者通常分布在全球各地,使得试验的管理复杂且昂贵。开展大型随机试验,甚至两项或多项关键性验证性研究,这对于孤儿药行业来说非常罕见。鉴于这些挑战,监管机构更倾向于基于不太全面,但支持证据足够的批准,以加快许多孤儿药通过临床试验,并最终为患者所得。
总结
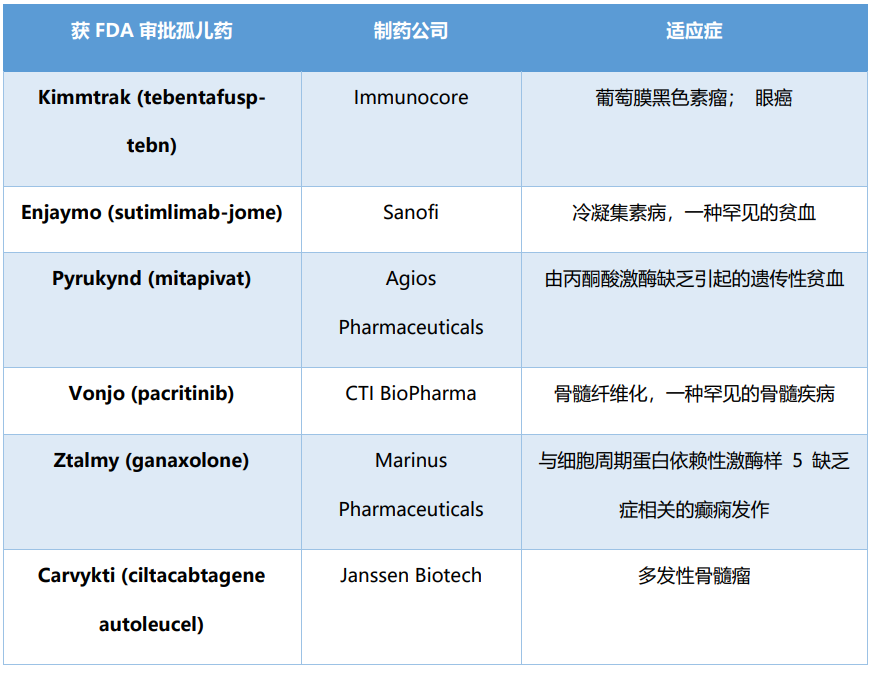
由于监管机构以及政府的激励措施,以及人类在对抗威胁生命的疾病过程中积累起来的信心,制药公司越来越关注罕见病。在孤儿药行业,多个流程之间存在关键联系,例如早期产品设计决策和可开发性、可制造性和“患者中心“,所有这些都是由降低风险同时加快时间线的愿望驱动的。尽管改变孤儿药立法的呼吁声音越来越强,但孤儿药市场的增长没有放缓的迹象。2022 年 3 月 4 日,FDA宣布将继续优先考虑罕见病,而这一表态得到了事实的明确支持。用于罕见病的药物的份额越来越大。在 2022 年前三个月,九项 FDA 治疗批准的新药中有六项是针对罕见疾病的 (表2)。三款为癌症药,两款为血液病药物,一款为神经病学药物。孤儿药市场的繁荣,对那些饱受罕见病折磨,尤其是那些儿童患者来说,无疑将是巨大的福祉。